Örökletes betegségek hajlamszűrése
Preventív célú genetikai módszerekkel azonosíthatóak azok a betegségek, melyekre Önnek a génállománya alapján emelkedett hajlama van. A betegségre való emelkedett kockázat ismeretében a megelőzésre irányíthatjuk életmódunkat vagy a szükséges terápiát.
Diagnosztikai laborunk a következő örökletes betegségek szűrését vállalja:
- Cisztás fibrózis
- Örökletes emlőrák
- Örökletes petefészekrák
- Öröklődő trombózis hajlam
- Tejcukor érzékenység
A vizsgálatok a legmodernebb technológia felhasználásával történnek, melynek érzékenysége lehetővé teszi a diagnosztikai eredmény nagyfokú pontosságát, megbízhatóságát. A vizsgálathoz elegendő egy egyszerű vérvétel.
Gyakran ismételt kérdések
Örökletes emlő- és petefészekrák
A BRCA1 és BRCA2 gének mutációiAz emlőrák hazánkban a nők leggyakoribb rosszindulatú daganata. Átlagosan a népességben mintegy 10% annak a kockázata, hogy egy nőnél emlő- vagy petefészekrák alakul ki élete folyamán.
Az esetek kb. 5-10%-ában az emlőrák hátterében örökletes génelváltozás (mutáció) áll, petefészekráknál ez az arány kb. 12%. Sok esetben ez a hajlam nem csak emlő- vagy petefészekrákra, hanem kisebb mértékben egyéb szervek daganatos elváltozásaira is vonatkozik (hasnyálmirigy, méh, méhnyak és prosztatarák).
Az emlőrákra hajlamosító örökletes mutációknak megközelítőleg a fele a BRCA1, egyharmada a BRCA2 génben található. BRCA1 és BRCA2 génben mutációt hordozó populáció körében, 55-88 %-os eséllyel alakul ki emlőrák 75 éves korig, míg a petefészekrák kialakulásának valószínűsége 26-48%.
A betegségek kialakulásának nagyarányú valószínűsége indokolttá teszi a BRCA1 és BRCA2 gének mutáció-analízisét a veszélyeztetett személyek esetében. Jelenleg a következő állapotok valamelyikének fennállása esetén javasolt genetikai szűrés elvégzése a családon belül:
- mindkét emlőben kialakult emlőrák
- több primer emlőrák vagy emlő és petefészek rák
- emlőrák férfiban
- a fenti 3 eset valamelyikének előfordulása elsőfokú rokonnál
- 40 éves kor előtt kialakuló emlőrák
- egy vagy több emlő- és egy vagy több petefészekrákos rokon egy ágon
- igazoltan BRCA1/2 mutációt hordozó rokon
A vizsgálattal igazolni lehet a már fennálló betegség örökletes természetét. Ugyanakkor, ha a mutáció formájában jelentkező genetikai hajlamot a még klinikai tüneteket nem mutató rokonok esetében is sikerül azonosítani, az lehetővé teszi a daganat korai szűrését, illetve a megfelelő sebészeti beavatkozások és kezelések elvégzését az érintetteken.
A petefészekrák elterjedése térképen
A petefészekrák miatt elhunytak száma 100 000 lakosból, életkorra standardizáltan, 2004-ben.
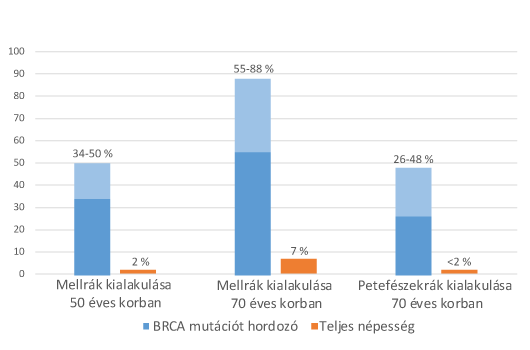
Milyen mértékben növeli az emlő és petefészek daganat kialakulásának kockázatát egy BRCA mutáció?
Az, hogy egy BRCA mutáció milyen mértékben növeli meg a daganat kialakulásnak kockázatát, minden esetben egyénenként értelmezhető és nagyon sok tényező együttesen befolyásolja. A kockázat mértéke így függ a mutáció génen belüli elhelyezkedésétől, az életkortól, terhességek számától, stb. A BRCA mutációt hordozók körében átlagosnak tekinthető kockázatnövekedést az ábra szemlélteti.
Gyakran ismételt kérdések
- Emlőrák 35 éves korban vagy korábban.
- Két vagy több elsőfokú rokon emlőrákkal (átlagéletkor < 50 év) vagy petefészekrákkal (bármely életkorban).
- Három vagy több közeli rokon emlő- és/vagy petefészekrákja két generációban (legalább egy daganat 50 év alatt).
- Férfi emlőrák (bármely életkorban).
- A családban kimutatott BRCA-mutáció.
Cisztás fibrózis
A CFTR gén mutációiA cisztás fibrózis (CF, cisztikus fibrózis, mukoviszcidózis) az egyik leggyakoribb veleszületett genetikai betegség, melyet a CFTR (cisztás fibrózis transzmembrán konduktancia regulátor) génben fellelhető eltérések (mutációk) okoznak.
Magyarországon minden 28. emberben a CFTR gén egyik kópiája hibás. Mára már több mint 1500 eltérést azonosítottak a CFTR génen belül. Kiemelendő a ΔF508del nevű mutáció, amely a betegek mintegy kétharmadánál felelős a kórkép kialakulásáért. A mutációk további egyharmada elszórtan lelhető fel a génben.
A CF gyakorisága indokolttá teszi a CFTR gén mutációs analízisét. Ez a vizsgálat Magyarországon egyelőre nem tartozik bele az újszülötteknél rutinszerűen elvégzett szűrésekbe, azonban több fejlett ország már jelenleg is felvette a rutin újszülöttkori szűrővizsgálatok közé.
A betegségben hiányzik, vagy nem működik jól a CFTR fehérje, ami az alábbi tüneteket okozza:
- A hasnyálmirigyben: emésztési problémák.
- A légzőrendszerben: krónikus, valamint rohamokban jelentkező köhögés, ismétlődő és krónikus tüdőgyulladás. Légzési problémák lépnek fel, sűrű váladék rakódik le a légutakban, emiatt a tüdő nem kap elegendő oxigént, így fokozatosan elhal.
- A mellékherékben: a mellékherék csatornáinak elzáródása miatt a férfi betegek 95%-a steril.
- A besűrűsödött nyák elzárja a külső elválasztású mirigyek kivezető csöveit, ami megváltozott nyáktermelésében mutatkozik meg.
- A csecsemőknél a meconium ileus, azaz a belek tartalmának besűrűsödése miatt bekövetkező elzáródás hívja fel a figyelmet a betegségre.
- Fehérjehiány
- A zsíroldékony vitaminok (A, D, E, K) hiányának jelei.
- Jellemző szinte az összes mirigy gyulladásos elváltozása.
A laborunkban kifejlesztett CFTR Diagnosztikai Kit lehetővé teszi a teljes gén analízisét, azaz az összes mutáció kimutatására alkalmas.
Cisztás fibrózisban szenvedő kisgyermek
A mukoviszcidózisos csecsemők tüdeje születéskor még normális, a tüdő és légutak nyálkahártyájának mirigyei azonban folyamatosan kórosan sűrű, nyákos váladékot termelnek, amely eltömi a léghólyagocskákat is, a tüdő légzőfelülete jelentősen csökken. A sűrű váladék nem tud természetes módon távozni, ezért a beteg kisgyermekek hosszas, kínzó köhögés kíséretében próbálnak tőle megszabadulni. Kezdetben a köhögés száraz, erős, szaggatott, később "felszakadozó", mintha oldódna. A sűrű váladék kedvez a különböző légúti fertőzések kórokozói megtelepedésének. Leggyakrabban a Staphylococcus aureus baktérium és a Pseudomonas fajok okoznak fertőzéseket. A legveszélyesebb a Pseudomonas aeruginosa, mely halálhoz vezető fertőzést okozhat.
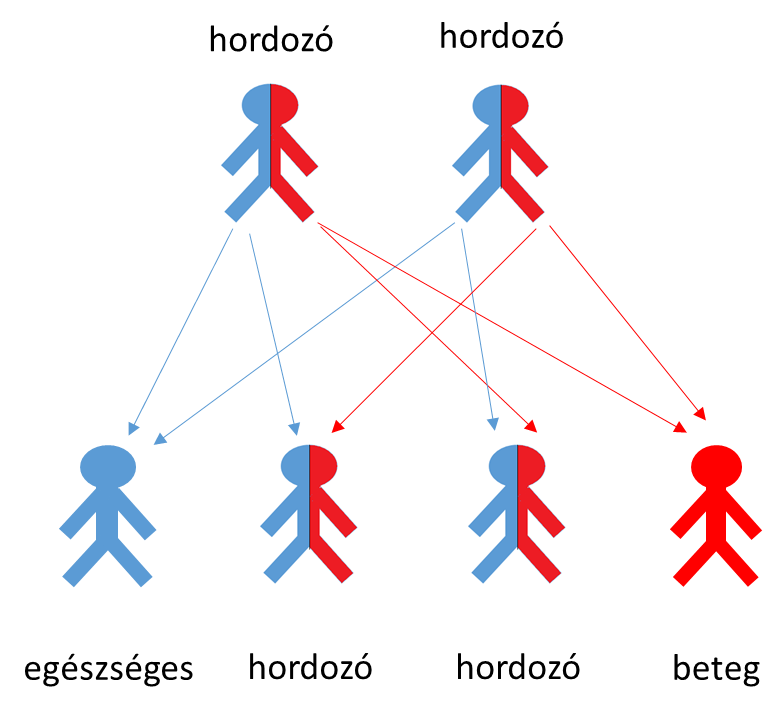
A betegség öröklődése a szülőkről a gyerekekre
Ha adott esetben mindkét szülő hordozza a mutációt a CFTR génben, akkor 25% annak a valószínűsége, hogy gyermekük beteg lesz.
Gyakran ismételt kérdések
Trombózisra hajlamosító gének
A vénás trombózis egy súlyos következményekkel járó betegség, amely multifaktoriális, vagyis kiváltó okai közt genetikai és környezeti tényezők egyaránt szerepelnek. Egy gyakori genetikai elváltozás, az ún. Leiden-mutáció (másnéven aktivált protein C rezisztencia) egy ilyen, genetikai eredetű véralvadási zavart okoz. Az öröklődő trombózishajlam 80%-ban ehhez az elváltozáshoz köthető. A mutáció miatt a betegeknek fokozottan alvadékony a vére, így trombózisra - azaz vérrögképződés okozta érelzáródásra - hajlamosak.
Az elváltozás igen gyakori, Magyarországon a népesség 10%-a hordozza. Ez azt jelenti, hogy a gén két példánya közül csak az egyiken van mutáció, azonban a trombózisra való hajlam már ekkor is 8-szorosára emelkedik. Ha mindkét génkópiánkon megtalálható a hibásodás, a kockázat 80-szorosára növekszik, ha semmilyen más további kockázati tényező nem áll fenn.
Az ismeretlen okú trombózisok 20%-ában, a terhesség alatt jelentkező trombózisoknak pedig mintegy 60%-ában kimutatható a mutáció. Továbbá az ismétlődő abortuszokkal, illetve terhességi komplikáiókkal is összefüggésben lehet a genetikai elváltozás.

A trombózishajlamot a genetikai okok mellett környezeti és életmódbéli tényezők is növelik, ilyenek például a hormonális fogamzásgátlók szedése, az elhízás, a dohányzás, a cukorbetegség, vagy a mozgásszegény életmód. De a várandósság, mint természetes állapot is jelentősen növelheti a rizikót, a trombózis pedig a magzati életet is veszélyeztető következményekkel jár. Ilyen esetben a nőgyógyásznak mindenképpen tudnia kell a mutáció jelenlétéről, mert a terhesség alatt szigorúan tilos a K-vitamin antagonisták adása.
A Leiden-mutáció (másnéven: trombofília, aktivált protein C rezisztencia) egy genetikai eredetű véralvadási zavar. A mutáció miatt a véralvadást elősegítő faktorok bomlásának lassulása következik be, emiatt a betegeknek fokozottan alvadékony a vére, így trombózisra - azaz vérrögképződés okozta érelzáródásra - hajlamosak. Az öröklődő trombózishajlam 80%-ban ehhez az elváltozáshoz köthető. A Leiden-mutáció esetében a trombózishajlam már heterozigóta formában (amikor a gén két példánya közül csak az egyiken van mutáció) is megnyilvánul, homozigóta formában (azaz, ha mindkét példányon megtalálható) pedig sokkal kifejezettebb. Az egészséges magyar népesség 10%-a heterozigóta a Leiden-mutációra, a homozigóták részaránya néhány ezrelék. A mutációt heterozigóta formában hordozó személyeknek kb. 8-szor, a homozigótáknak pedig kb. 80-szor akkora a kockázata mélyvénás trombózisra, mint az átlag népességnek, ha semmilyen más további kockázati tényező nem áll fenn.
Fontos, hogy fiatal korban jelentkező, mással nem magyarázható és/vagy ismétlődő trombózis kapcsán minden esetben történjen meg a Leiden-mutáció kizárása. Amennyiben a betegnek vannak gyermekei vagy élnek a szülei, a vizsgálatot náluk is el kell végezni.
A protrombin vagy II. alvadási faktor mutációja az örökletes trombózishajlam második leggyakoribb oka. Az elváltozás miatt emelkedett protrombin szint alakul ki, ennek következtében a véralvadási rendszer aktivitása fokozódik, így nő a trombózis kialakulásának esélye. Ez a génelváltozás az átlagos népesség 2%-át érinti. A mélyvénás trombózis kockázatát mintegy 3-szorosára növeli. A mutációt heterozigóta formában hordozó nőkben a szívinfarktus kialakulásának kockázata négyszer nagyobb, mint a mutációt nem hordozókban, és a kockázat fokozódik, ha más rizikótényező (dohányzás, fogamzásgátló gyógyszer) is fennáll. Homozigóta formában nagyon ritka, de egyes tanulmányok szerint az ismétlődő vetélések hátterében is ez a mutáció állhat.
A mutáció vizsgálata javasolt viszonylag fiatal korban előforduló agyi érelzáródás (szélütés), illetve nőknél szívinfarktus bekövetkezése esetében, ismételt vetéléseket követően, illetve amennyiben igazoltan van a családban protrombin mutációt hordozó rokon.
Az MTHFR (metiléntetrahidrofolát reduktáz) gén mutációja örökletes módon fokozza a vér homocisztein szintjét. A vér emelkedett homociszteinszintje a népesség 5-10%-ában fordul elő, a trombózis kockázata ilyenkor a normális homociszteinszintű személyekéhez képest csaknem 3-szoros. Ez az artériás és vénás trombózis, valamint terheseknél a magzati elhalás ismert kockázati tényezője, továbbá fokozza a magzati velőcsőzáródási rendellenesség kockázatát. Az emelkedett homocisztein szint (hiperhomociszteinémia) kialakulásának nagyobb a valószínűsége, ha csökkent a szervezet folsav ellátottsága, így fokozott folsav bevitellel csökkenthető a vér homocisztein szintje. A mutáció vizsgálata javasolt emelkedett szérum homocisztein szint esetén.
A mutáció heterozigóta formája esetén egyáltalán nem, vagy csak kis mértékben emelkedik a homocisztein koncentrációja a szérumban, azonban homozigóta formában ez az emelkedés már jóval kifejezettebb. A populációban a homozigóta mutáció előfordulása viszonylag gyakori, az átlagnépesség 5-15%-ában fordul elő.
Gyakran ismételt kérdések
- csökkenti, vagy abbahagyja a dohányzást
- fokozott testmozgást iktat be mindennapjaiba
- rendszeres orvosi ellenőrzést biztosít
- csökkenti a koleszterin-dús ételek fogyasztását

Fogamzásgátlók és a Leiden-mutáció
Ha Ön Leiden mutációt hordoz, és emellett fogamzásgátlót szed, a trombózis kockázata 8-szorosról akár 30-40-szeresre is emelkedhet. Ha Önnek mindkét allélja mutáns, fogamzásgátló szedése mellett ugyanez a kockázat 80-szorosról több mint 100-szorosra nő. Ezért a vizsgálat elvégzése javasolt fogamzásgátló használata előtt.
Tejcukor-érzékenység
Laktóz-intoleranciaA tejben található tejcukor, a laktóz emésztését a vékonybélben működő laktáz enzim végzi. Ennek mennyisége születéskor a legmagasabb, majd az életkor előrehaladtával csökken, így a laktózbontó-képesség is megszűnik. Az emésztetlen laktóz emésztőszervi panaszok széles skálájáért felelős, ilyen a szabad víztartalom megnövekedése, a felgyorsult béltranzit és a keletkezett hidrogén. A laktóz-intolerancia valójában egy evolúciósan ősi állapot, mivel a felnőtt emlősállatoknak nem kell tejcukrot emészteniük. Hazai adatok alapján a magyar felnőtt populáció kb. 35-40%-a valamilyen mértékben laktózérzékeny. Az emberek egy jelentős része azonban egész életében képes tejtermékek fogyasztására, az észak-európai és az India észak-nyugati részéről származó populációk tagjainál felnőttkorban is elegendő mértékű a laktáz aktivitás. Ennek oka a laktáz gén két pontjában jelenlévő variáns, amely befolyásolja az enzim termelődésének megszűnését. Az egyes népcsoportok közti igen nagy variabilitás hátterében a népek eltérő tejfogyasztási szokásai állnak. Laktóz-érzékenyeknél a tej fogyasztását követően típusos panaszok jelentkeznek (hasmenés, görcsös hasi fájdalom, puffadás, hányinger), melyek megszűnnek, illetve enyhíthetők tejcukor-mentes étrend bevezetésével.
A vizsgálatot javasoljuk elvégezni:
- csecsemőknél, esetükben létezik veleszületett tejcukor-érzékenység, melynek során már az anyatejet sem képesek megemészteni. Fontos elkülöníteni a tejfehérje érzékenységtől a megfelelő táplálás kiválasztása érdekében.
- akinél tej vagy tejtermék fogyasztását követően emésztőrendszeri panaszok jelentkeznek.
- akinek családjában van tejcukor érzékeny személy (tekintettel arra, hogy a laktóz intolerancia genetikailag meghatározott).
- akinek laktóz intoleranciára jellemző emésztőrendszeri panaszaik vannak annak ellenére, hogy nem fogyaszt tejterméket. Arra érzékeny személyeknél a panaszokat okozhatja a feldolgozott élelmiszerekben gyakran előforduló úgynevezett rejtett laktóz is.
A korai diagnózis fontos, mert:
- laktóz fogyasztásakor a kellemetlen tünetek mellett folyamatosan károsodik a vékonybél felszívó felülete.
- ennek következtében más tápanyagok sem szívódnak fel, nem hasznosulnak a szervezetben, tápanyagok hiánya alakul ki.
- hosszabb távon visszafordíthatatlan súlyos betegségek alakulhatnak ki (pl. csontritkulás) a vékonybél felszívó felületének nagymértékű károsodása következtében.
- a vastagbélben a laktózt bontó bélbaktériumok savas közeget teremtenek, amely a vastagbél rosszindulatú daganatával áll összefüggésben.

