A molekuláris diagnosztikáról általában
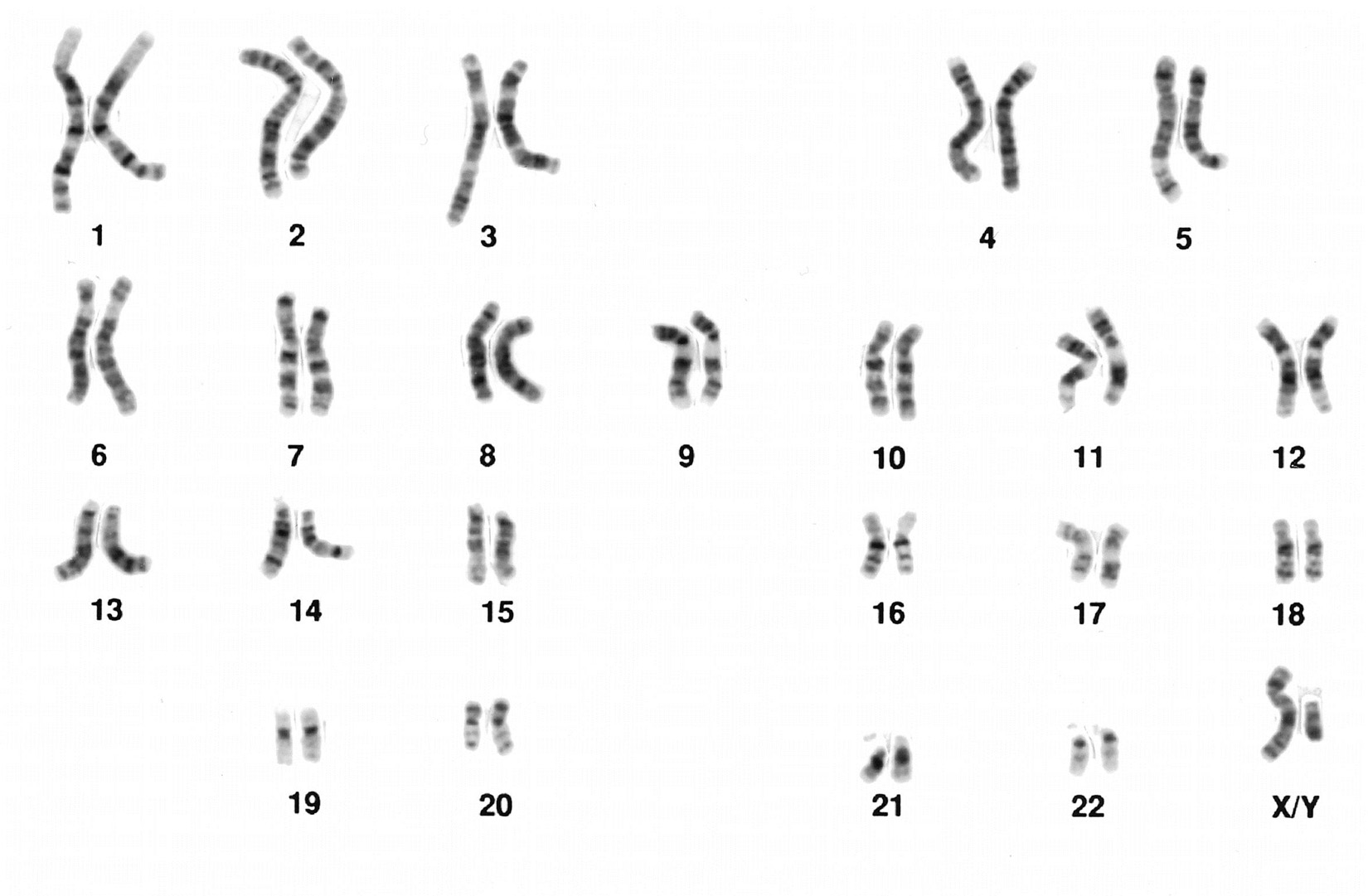
Fogantatásunk pillanatában 23 kromoszómát, vagyis egy genomnyi információt öröklünk mind édesanyánktól, mind édesapánktól. Ez a kétszer 23 kromoszóma a továbbiakban minden testi sejtünkben jelen lesz, és sejtjeink, végső soron pedig életünk működését határozza meg.
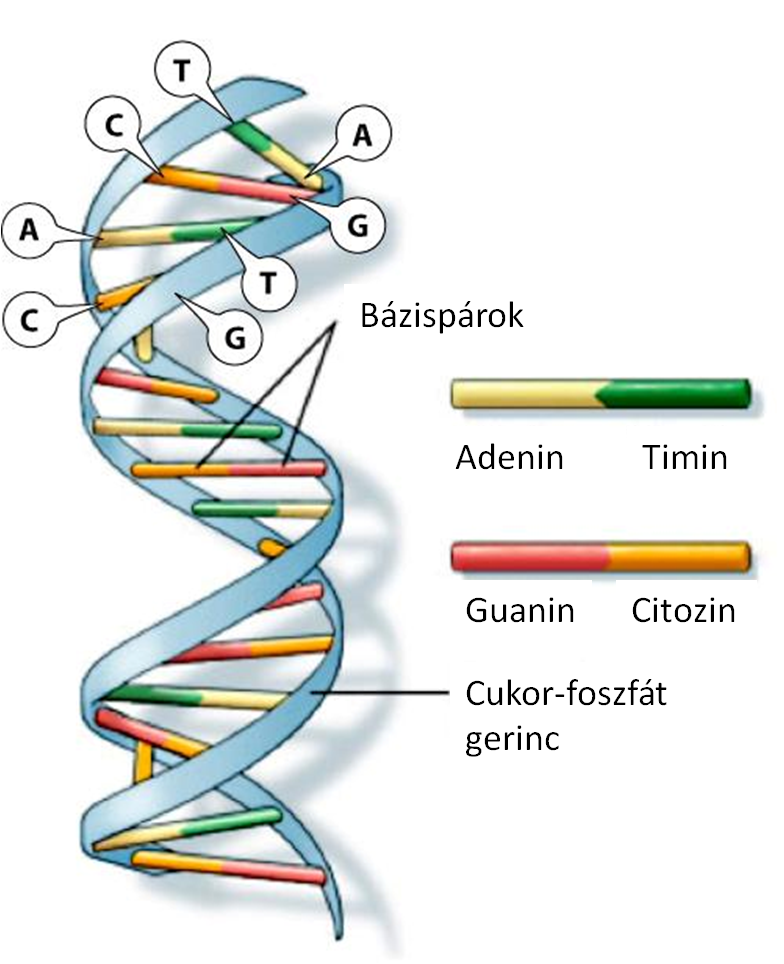
Tulajdonságaink mind-mind visszavezethetők egy-egy meghatározott szakaszra az örökítőanyagunkban, melyeket géneknek hívunk. Génjeink pedig úgy közvetíthetnek tulajdonságokat, hogy az általuk kódolt információ egy-egy fehérjét határoz meg, amely egy speciális funkció betöltésére hivatott a sejtben. De hogyan kódolja a szervezetünk működésére vonatkozó információt az örökítőanyagunk, a DNS? A válasz a kombinációban rejlik. A genetikai kód mindössze 4 különböző karakterből, nukleotidból áll, ezek sorrendje határozza meg azt a programot, amely szerint felépülnek a fehérjéink.
A molekuláris diagnosztika a genetikai állomány, illetve a fehérjék szintjén vizsgálja a páciens egészségi állapotát vagy esetleges betegsége jelenlétét.
Ha egy betegségtípus egy családon belül halmozottan fordul elő, az előrevetíti, hogy annak hátterében az örökítőanyag, vagyis DNS-ünk meghibásodása áll, ezek az öröklödő betegségek. Ilyen esetben testünk minden sejtje hordozza az adott genetikai elváltozást. Az elváltozás nem csak betegséget jelenthet. A hajlam egy bizonyos betegségtípusra ugyanilyen módon továbbadódhat a szülőkről az utódokra.
Genetikai eredetű betegségek azonban az egyén egyedi élete során is kialakulhatnak, ha testünk egy sejtjének örökítőanyagában vagy annak szabályozásban hiba jön létre. Ez jellemzően nem mutat a családon belül emelkedett gyakoriságot, inkább szórványosan fordul elő a társadalomban. A rákos megbetegedések túlnyomó többsége ide sorolható. A genetikai eredetű betegségek hátterében minden esetben van egy vagy több olyan, a ”normálistól” való elváltozás, mutáció, amely a kialakulásért, vagy a lefolyásért alapjaiban felelős. Ha ezt felismerjük, okszerűbb kezelést alkalmazhatunk a betegséggel szemben.
Bennet Cassell, Professor and Extension Specialist, Dairy Science, Virginia Tech; pages 404-090.
Az új évezred kezdetén példa nélküli lehetőséget teremtett meg az orvostudomány számára a teljes emberi genom nukleotidsorrendjének megfejtése és a gének fizikai és funkcionális szempontból történő feltérképezése. A humán genom program eredményei kétségkívül hozzájárultak ahhoz a forradalmi változáshoz a medicinában, amely a célzottan ható, személyre szabott terápiás szerek és az ezekhez nélkülözhetetlen diagnosztikát megteremtették.
A diagnosztika az egészségügyi ellátásban kritikus szerepet játszik, mivel eredménye az orvosi döntéshozást és a kezelés irányát alapjaiban határozza meg. Szerepe a betegellátás folyamán több helyen is kulcsfontosságú. Kezdve a hajlamosító faktorok kimutatásától a magas kockázatú betegek korai kiszűrésén át a betegség állapotának, előrelátható lefolyásának becsléséig, a megfelelő, személyreszabott terápia kiválasztásáig, vagy akár a kiújulás vagy a terápia hatékonyságának monitorozásáig. Nem kérdés, hogy ennek fényében miért is olyan fontos, hogy a diagnosztika célzottan, és nagy felbontásban, a tünetek mögötti molekuláris mechanizmusokat feltárva történjen.
Bővebb információk a vizsgált génekről
Cisztás fibrózisA leggyakoribb öröklődő betegség, a cisztás fibrózis hátterében már 1989 óta tudjuk, hogy a CFTR gén meghibásodása áll. A betegséget okozó génvariánsok száma azonban a mai napig is folyamatosan bővül, ahogyan a különböző súlyosságú és lefolyású páciensek genetikai vizsgálatával a génnek illetve az őt kódoló fehérjének újabb és újabb defektusára kerül fény.
Ezek az eredmények alapozzák meg ennek a heterogén kórképnek a különböző variánsaira alkalmazható célzottan ható molekulák kiválasztását.
Cystic fibrosis genetics: from molecular understanding to clinical application.
Cutting GR. Nat Rev Genet. 2015 Jan;16(1):45-56. doi: 10.1038/nrg3849. Epub 2014 Nov 18. Review.
A célzott terápia a nőket érintő leggyakoribb daganatos betegségek terén is forradalmi változásokat hozott. A mellrákos betegek bizonyos részében azonosított biomarker, a HER2 gén gátlására célzottan megtervezett vegyülettel a tumorigenezis folyamatába hatékonyan beavatkozhatunk, így ezeknél a betegeknél jelentős javulást érhetünk el.
HER2 in breast cancer: a review and update.
dv Anat Pathol. 2014 Mar;21(2):100-7. doi: 10.1097/PAP.0000000000000015.
Krishnamurti U1, Silverman JF.
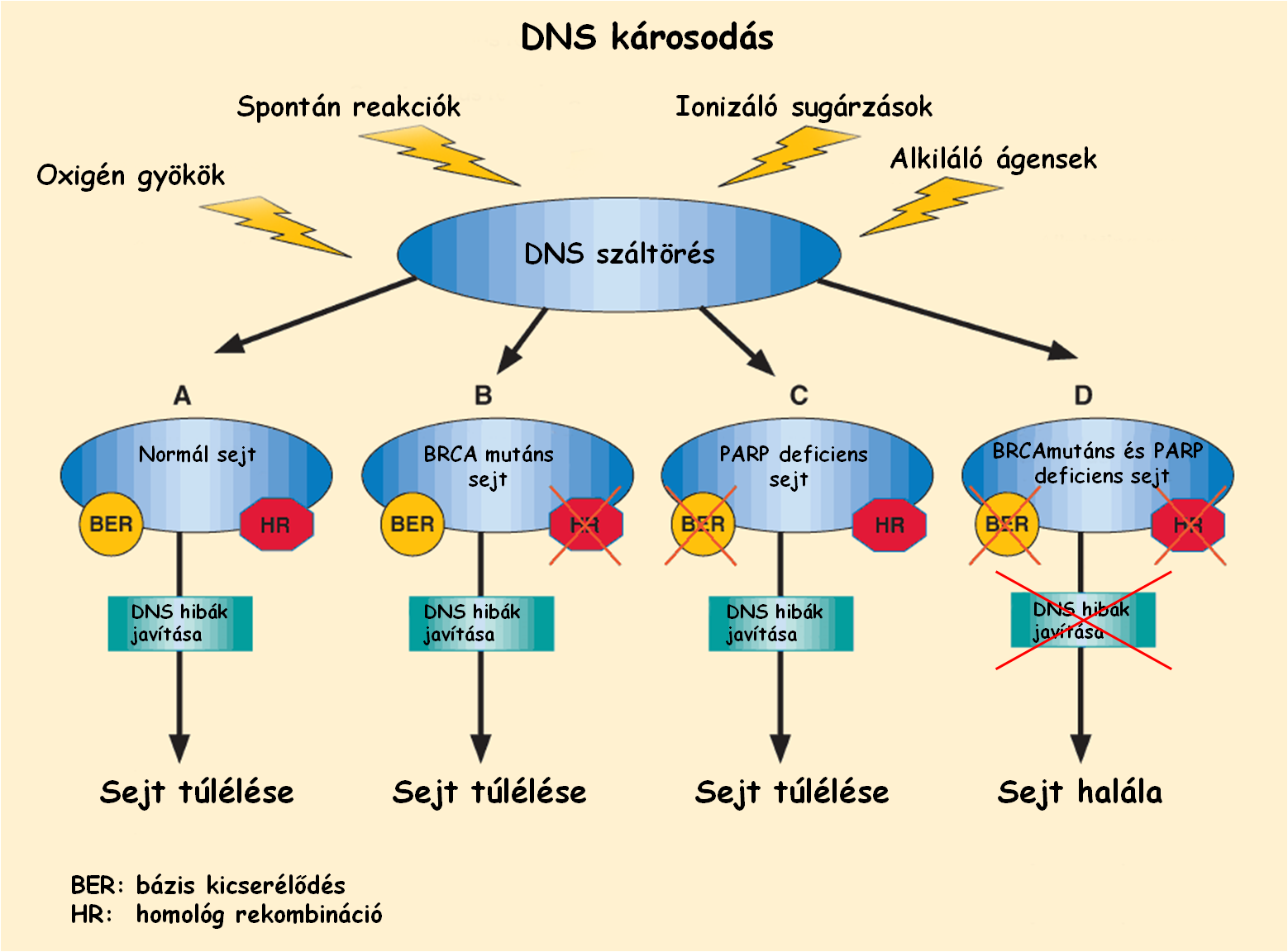
Az emlő, valamint a petefészekrák terápiája terén a közelmúltban újabb mérföldkőhöz érkeztünk. Ebben az esetben a több, mint két évtizede leírt BRCA1 és BRCA2 gének meghibásodásával szemben jelent meg személyre szabott rákterápia, amely jelenleg a petefészekrákos betegek számára jelent hatékony, és kis mellékhatással rendelkező terápiát. A közelmúltban felfedezett terápia hatásmechanizmusa jó példa arra az esetre, amikor nem a meghibásodott génre, illetve az azt kódoló fehérjére hat a szer, hanem a ráksejtek menekülőútvonalát elvágva azt a fehérjét gátolja, amely a túlélésüket biztosítaná a DNS károsodásokkal szemben. A poli (ADP-ribóz)-polimeráz (PARP) fehérje olyan enzimaktivitással rendelkezik, amely a DNS károsodásainak hibajavításában játszik szerepet, akárcsak a BRCA1 és BRCA2 fehérjék.
Régóta ismert, hogy az örökletes mell- és petefészekrákok bizonyos hányadánál a BRCA 1, valamint 2 gén valamelyike mutációt hordoz. A mutáns kópia tehát megnöveli a rák kialakulásának kockázatát, hiszen a sejt egyik fontos DNS hibajavító mechanizmusa károsodott. Ha ezekben a sejtekben egy célzott PARP-gátló szerrel blokkoljuk a másik fontos hibajavító gépezetet, a sejtek nem képesek a DNS károsodásokat kijavítani, és elpusztulnak. Az egészséges sejtek viszont, amelyek rendelkeznek a BRCA egészséges kópiájával, nem károsodnak.
Olaparib: an oral PARP-1 and PARP-2 inhibitor with promising activity in ovarian cancer.
Gunderson CC, Moore KN.
Future Oncol. 2015;11(5):747-57. doi: 10.2217/fon.14.313. Review.
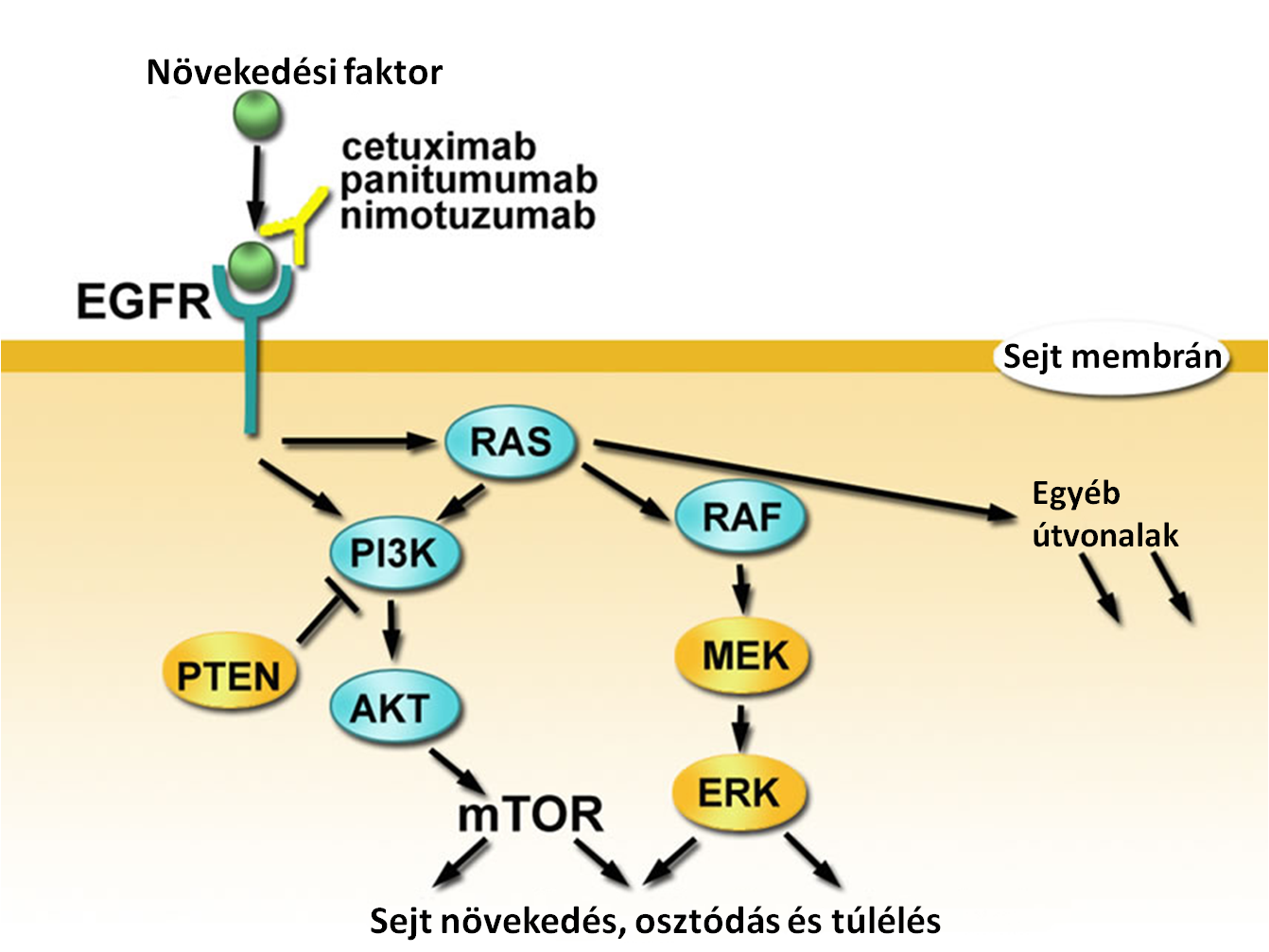
Az EGFR (Epidermal growth factor receptor) egy olyan receptor fehérje, amely a sejtek felszínén található. Ehhez a receptorhoz különböző kis molekulák (elsősorban növekedési faktorok) kapcsolódnak, amelyek a receptor aktiválódását idézik elő. Az aktiválódott receptor jeleket küld a sejt belsejébe, olyan géneket aktiválva, amelyek végső soron sejtosztódáshoz, sejtnövekedéshez, érhálózat fejlődéséhez és áttétképződéshez vezetnek. Számos folyamat vezethet a normálistól eltérő receptor-aktivációhoz. Ezek közé tartozik a receptor túltermelődése, különböző (fent említett) mutációk kialakulása, illetve egyéb mechanizmusok. Az EGFR abnormálisan magas szinten található sokféle típusú rákos sejt felszínén.
A vastag- és végbél-, valamint nemkissejtes tüdőtumorok kezelésének jelenleg leghatékonyabb módja az úgynevezett EGFR jelátviteli útvonalat célozza meg annak gátlása által. Az utóbbi időben számos EGFR-gátló anyagot fejlesztettek ki, ami gátolja a jelátviteli útvonalakat megnövelve ezzel a tumoros beteg túlélését. Ezek olyan gyógyszerek, melyek az EGFR receptorhoz kapcsolódnak, ami annak inaktiválódását eredményezi, ez pedig az EGFR jeladás gátlásához, azaz a sejtosztódás, áttétképződés stb. megállásához vezet. Éppen ezért az EGFR gén bizonyos régióinak diagnosztikája elengedhetetlen a megfelelő, hatásos tumorterápia kiválasztásához. Ezek a gyógyszerek nem hatásosak azonban, ha az EGFR jelátviteli útvonal következő tagjaiban (KRAS, NRAS, BRAF, PIK3CA) mutáció található.
A célzott terápia hatékonyságának felméréséhez tehát elengedhetetlen a KRAS, NRAS, BRAF, PIK3CA gének vizsgálata, hiszen ha ezekben a génekben mutáció található, akkor az EGFR-gátló terápia a daganatsejtekre hatástalan marad, viszont az egész szervezetben előforduló mellékhatások megmaradnak és tovább gyengíthetik a szervezetet.
A tumorszövethez, mint vizsgálati anyaghoz azonban csak műtéti úton juthatunk hozzá, ami rendkívül megterhelő a beteg számára, sőt, olykor a páciens állapota nem is teszi lehetővé az invazív beavatkozást.
Az utóbbi években azonban rendkívül forrongó kutatási területté vált a nem-invazív genetikai diagnosztika. Segítségével a tumorszövetből származó sejtekből kikerült, szabadon keringő DNS analizálható. A testfolyadékok, mint a vérplazma, nyál, vagy a vizelet már korai stádiumban is tartalmazhatja a rákos sejtek genetikai örökítőanyagát. Így akár egy egyszerű vérvétellel genetikai információhoz juthatunk a tumorral kapcsolatosan.
Cheng-Bo Han1*, Jie-Tao Ma1, Fan Li2, Hua-Wei Zou1
Journal of Cancer Therapy
Vol.2 No.5(2011), Article ID:16613,8 pages DOI:10.4236/jct.2011.25090

Nature Reviews Cancer 11, 426-437 (June 2011) | doi:10.1038/nrc3066
Heidi Schwarzenbach1, Dave S. B. Hoon2 & Klaus Pantel1
A nem-invazív molekuláris diagnosztika, mely kétségkívül forradalmasítja a jövőben a genetikai vizsgálati módszereket, szintén fejlesztéseink középpontjába került az utóbbi időben. Saját fejlesztésű, új-generációs szekvenálás-alapú kitjeink alkalmasak a vérplazmában található szabad DNS-ből az EGFR útvonal fent említett tagjainak mutációanalízisére
Blood as a Substitute for Tumor Tissue in Detecting EGFR Mutations for Guiding EGFR TKIs Treatment of Nonsmall Cell Lung Cancer: A Systematic Review and Meta-Analysis.
Mao C1, Yuan JQ, Yang ZY, Fu XH, Wu XY, Tang JL.
PMID: 26020382 PMCID: PMC4616411 DOI: 10.1097/MD.0000000000000775
Az általunk használt módszerekről
A DNS-t alkotó nukleotidok sorrendjének (szekvenciájának) leolvasását DNS-szekvenálásnak, vagy egyszerűen csak szekvenálásnak hívják. Ehhez jelenleg többféle módszer is használható, azonban mindegyik módszerhez az első lépés az, hogy a DNS-t ki kell vonnunk az azt hordozó sejtekből. Ez öröklődő genetikai betegségek vizsgálatának esetén történhet a vérben lévő fehérvérsejtekből vagy akár a száj nyálkahártyájából történő fájdalommentes kenetvétellel. Személyre szabott rákdiagnosztika esetén a DNS-t közvetlenül a daganatból származó sejtekből kell kivonni, amelyet a tumor rutin vizsgálata során történő biopsziából nyerünk.
A DNS izolálása után, a vizsgálat típusától függően választjuk ki a nukleotid szekvencia leolvasásának megfelelő módszerét. Már ismert öröklődő elváltozások vizsgálata esetén kapilláris vagy Sanger szekvenálást alkalmazunk, amely 700-1000 nukleotid hosszú szekvenciák egyszeri leolvasását teszi lehetővé gazdaságosan.

Sanger féle DNS szekvenálás
A kapilláris szekvenátor négy különböző szín leolvasásával állapítja meg egy adott DNS szakasz nukleotid sorrendjét.
Amennyiben egész géneket (pl.: BRCA1) szükséges leolvasni, vagy a tumor mintákban keverednek az egészséges és daganatos sejtek, abban az esetben az utóbbi évtized látványosan fejlődő szekvenálási technológiáját, az újgenerációs szekvenálási eljárást alkalmazzuk, amely ugyancsak 100-300 nukleotid hosszú szekvenciák leolvasására képes, azonban egy vizsgálat során akár több 10 millió különböző helyről képes egyszerre információt szolgáltatni. Jelenleg a molekuláris genetikában nincs ennél korszerűbb módszer, az általunk végzett technológiai fejlesztések a nemzetközi élvonalba tartoznak.
Újgenerációs szekvenálás
Az Újgenerációs szekvenátorok az egy mintában jelenlévő sok egyedi DNS molekula nukleotid sorrendjét képesek megállapítani, ennek megfelelően sok hasonló szekvenciát kapunk egy ilyen vizsgálat eredményképpen.
Mindkét szekvenálási módszert használva megállapítjuk, hogy van-e olyan eltérés az „átlagos” emberi DNS szekvenciától, amely oka lehet egy adott betegségnek, vagy akadályozhatja bizonyos tumorterápiák alkalmazását. Ehhez a genetikai elváltozásokat tartalmazó adatbázisokon kívül minden esetben a tudományos szakirodalmat hívjuk segítségül, ezzel is biztosítva, hogy a hozzánk fordulók naprakész információkhoz juthassanak.

Illumina NextSeq 500 szekvenátor
Némileg nagyobb volumenű szekvenálásokra szolgál a NextSeq 500 platform. 1 futtatásból maximum 400 millió leolvasás, 120 Gb nyerhető ki, 150 bp-os leolvasási hosszal readenként. Ekkora léptékű adatot már teljes exomok és transzkriptomok képeznek, de egy ilyen futtatással már teljes genomok, akár 1 humán genom is megszekvenálható.

Illumina MiniSeq szekvenátor
Az Illumina MiniSeq platformja maximális kapacitása futásonként 8 Gb, 25 millió read nyerhető egy futásból, az egyes readek leolvasási hossza maximum 150 bp. Ideális választás targetált DNS és RNS szekvenálásra, egyes gének illetve jelátviteli útvonalak vizsgálatára. Kisebb léptékű szekvenálási projektekhez ideális választás lehet a technológiájához képest gazdaságosabb üzemeltetési költsége miatt.